
 แอลเคน หมายถึงสารประกอบไฮโดรคาร์บอนที่พันธะระหว่างคาร์บอนยึดเหนี่ยวด้วยพันธะ เดี่ยว จัดเป็นสารประกอบไฮโดรคาร์บอนประเภทอิ่มตัว มีสูตรทั่วไปเป็น CnH2n+2 เมื่อ n คือจำนวนอะตอมของคาร์บอน โดยเริ่มต้นตั้งแต่ C 1 อะตอม แอลเคน หมายถึงสารประกอบไฮโดรคาร์บอนที่พันธะระหว่างคาร์บอนยึดเหนี่ยวด้วยพันธะ เดี่ยว จัดเป็นสารประกอบไฮโดรคาร์บอนประเภทอิ่มตัว มีสูตรทั่วไปเป็น CnH2n+2 เมื่อ n คือจำนวนอะตอมของคาร์บอน โดยเริ่มต้นตั้งแต่ C 1 อะตอม
สมบัติของแอลเคน
สมบัติทางกายภาพ
 1. เป็นโมเลกุลไม่มีขั้ว ไม่ละลายน้ำ แรงยึดเหนี่ยวระหว่างโมเลกุลเป็นแรงลอนดอน จุดหลอมเหลว–จุดเดือดจึงต่ำมาก ซึ่งเพิ่มขึ้นตามจำนวนอะตอมของคาร์บอนที่เพิ่มขึ้น 1. เป็นโมเลกุลไม่มีขั้ว ไม่ละลายน้ำ แรงยึดเหนี่ยวระหว่างโมเลกุลเป็นแรงลอนดอน จุดหลอมเหลว–จุดเดือดจึงต่ำมาก ซึ่งเพิ่มขึ้นตามจำนวนอะตอมของคาร์บอนที่เพิ่มขึ้น
 2. ที่อุณหภูมิห้อง แอลเคนที่มี C 1-4 อะตอม เป็นแก๊ส 5–17 อะตอม เป็นของเหลว และ 18 อะตอมขึ้นไปเป็นของแข็ง 2. ที่อุณหภูมิห้อง แอลเคนที่มี C 1-4 อะตอม เป็นแก๊ส 5–17 อะตอม เป็นของเหลว และ 18 อะตอมขึ้นไปเป็นของแข็ง
 3. ความหนาแน่นน้อยกว่าน้ำ 3. ความหนาแน่นน้อยกว่าน้ำ
 4. เป็นสารประกอบที่ไม่มีสี ไม่มีกลิ่น เมื่อนำมาใช้เป็นเชื้อเพลิงต้องเติมสารที่มีกลิ่นลง เพื่อตรวจสอบการรั่วของแก๊ส 4. เป็นสารประกอบที่ไม่มีสี ไม่มีกลิ่น เมื่อนำมาใช้เป็นเชื้อเพลิงต้องเติมสารที่มีกลิ่นลง เพื่อตรวจสอบการรั่วของแก๊ส
สมบัติทางเคมี
 1. การเผาไหม้ สารประกอบแอลเคนสามารถลุกไหม้ดีดี ไม่มีเขม่าและควัน เมื่อเทียบกับไฮโดรคาร์บอนชนิดอื่นที่มีจำนวนอะตอมคาร์บอนเท่ากัน เช่น 1. การเผาไหม้ สารประกอบแอลเคนสามารถลุกไหม้ดีดี ไม่มีเขม่าและควัน เมื่อเทียบกับไฮโดรคาร์บอนชนิดอื่นที่มีจำนวนอะตอมคาร์บอนเท่ากัน เช่น
2 C4H10(g) + 13 O2(g) ---------> 8 CO2(g) + 10 H2O(g)
2C6H14(g) + 19 O2(g) -----------> 12 CO2(g) + 14 H2O(g)
 2. ปฏิกิริยาแทนที่ แอลเคนเป็นสารประกอบไฮโดรคาร์บอนอิ่มตัว ซึ่งหมายถึงมีพันธะระหว่างอะตอมคาร์บอนเป็นพันธะเดี่ยว สามารถเกิดปฏิกิริยากับเฮโลเจน (halogen : F , Cl , Br , I) ได้ในที่มีแสงสว่าง โดยเกิดปฏิกิริยาแทนที่ (substitution reaction) โดยอะตอมของเฮโลเจนจะแทนที่อะตอมของไฮโดรเจน 1 อะตอม ไฮโดรเจนที่ถูกแทนที่จะรวมกับเฮโลเจนเกิดเป็นแก๊สไฮโดรเจนเฮไลด์ (HX เมื่อ X แทนธาตุเฮโลเจน F , Cl , Br , I) ซึ่งเป็นแก๊สที่มีสมบัติเป็นกรด 2. ปฏิกิริยาแทนที่ แอลเคนเป็นสารประกอบไฮโดรคาร์บอนอิ่มตัว ซึ่งหมายถึงมีพันธะระหว่างอะตอมคาร์บอนเป็นพันธะเดี่ยว สามารถเกิดปฏิกิริยากับเฮโลเจน (halogen : F , Cl , Br , I) ได้ในที่มีแสงสว่าง โดยเกิดปฏิกิริยาแทนที่ (substitution reaction) โดยอะตอมของเฮโลเจนจะแทนที่อะตอมของไฮโดรเจน 1 อะตอม ไฮโดรเจนที่ถูกแทนที่จะรวมกับเฮโลเจนเกิดเป็นแก๊สไฮโดรเจนเฮไลด์ (HX เมื่อ X แทนธาตุเฮโลเจน F , Cl , Br , I) ซึ่งเป็นแก๊สที่มีสมบัติเป็นกรด
หมู่แอลคิล (Alkyl group : R)
หมู่แอลคิล หมายถึงแอลเคนที่สูญเสียไฮโดรเจน 1 อะตอม มีสูตรทั่วไปเป็น CnH2n+1 ใช้สัญลักษณ์แทนด้วย R หมู่แอลคิลจะพบในโซ่ของไฮโดรคาร์บอนที่เป็นโซ่กิ่ง (branched chain) ซึ่งแยกจากโซ่หลักของคาร์บอน
การเรียกชื่อหมู่แอลคิลใช้หลักการเดียวกับแอลเคน แต่ลงท้ายเสียงเป็น –อิล (–yl)
สูตรและชื่อของหมู่แอลคิลเปรียบเทียบกับแอลเคนที่เป็นโซ่ตรง
จำนวนอะตอม C |
ชื่อของแอลเคน |
สูตรโครงสร้างของแอลเคน |
สูตรโครงสร้างของหมู่แอลคิล |
ชื่อของหมู่แอลคิล |
1 |
มีเทน
(methane) |
CH4 |
CH3– |
เมทิล
(methyl) |
2 |
อีเทน
(ethane) |
CH3CH3 |
CH3CH2– |
เอทิล
(ethyl) |
3 |
โพรเพน
(propane) |
CH3CH2CH3 |
CH3CH2CH2– |
โพรพิล
(propyl) |
4 |
บิวเทน
(butane) |
CH3CH2CH2CH3 |
CH3CH2CH2CH2– |
บิวทิล
(butyl) |
5 |
เพนเทน
(pentane) |
CH3CH2CH2CH2CH2CH3 |
CH3CH2CH2CH2CH2– |
เพนทิล
(pentyl) |
6 |
เฮกเซน
(hexane) |
CH3CH2CH2CH2CH2CH3 |
CH3CH2CH2CH2CH2CH2– |
เฮกซิล
(hexyl) |
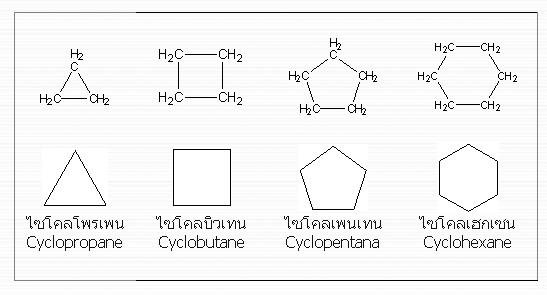
ไซโคลแอลเคน (Cycloalkane)
 ไซโคลแอลเคน เป็นไฮโดรคาร์บอนที่มีโครงสร้างเป็นวง พันธะระหว่างอะตอมคาร์บอนยึดเหี่ยวด้วยพันธะเดี่ยว เป็นสารประกอบไฮโดรคาร์บอนอิ่มตัวเช่นเดียวกับแอลเคน มีสูตรทั่วไปเป็น CnH2n โดยประกอบด้วยคาร์บอนตั้งแต่ 3 อะตอมขึ้นไป ไซโคลแอลเคน เป็นไฮโดรคาร์บอนที่มีโครงสร้างเป็นวง พันธะระหว่างอะตอมคาร์บอนยึดเหี่ยวด้วยพันธะเดี่ยว เป็นสารประกอบไฮโดรคาร์บอนอิ่มตัวเช่นเดียวกับแอลเคน มีสูตรทั่วไปเป็น CnH2n โดยประกอบด้วยคาร์บอนตั้งแต่ 3 อะตอมขึ้นไป
การเรียกชื่อไซโคลแอลเคน
 เรียกเหมือนกับแอลเคน แต่นำหน้าชื่อด้วยคำว่า “ไซโคล” (cyclo) เช่น ไซโคลโพรเพน ไซโคลบิวเทน เป็นต้น เรียกเหมือนกับแอลเคน แต่นำหน้าชื่อด้วยคำว่า “ไซโคล” (cyclo) เช่น ไซโคลโพรเพน ไซโคลบิวเทน เป็นต้น
ประโยชน์ของแอลเคน
1. CH4 ใช้เป็นเชื้อเพลิงในโรงไฟฟ้า และโรงงานต่าง ๆ ใช้เป็นวัตถุดิบในการผลิตเคมีภัณฑ์ต่าง ๆ เช่น เมทานอล(CH3OH) นอกจากนี้ ยังใช้กับรถยนต์ เรียกว่าแก๊ส NGV (Natural Gas for Vehicle)
2. อีเทน (C2H6) และโพรเพน (C3H8) ใช้ในการผลิตเอทิลีน (C2H4) และโพรพิลีน (C3H6) เพื่อเป็นสารตั้งต้นในการผลิตเม็ดพลาสติก
3. แก๊สผสมระหว่างโพรเพน (C3H8) กับบิวเทน (C4H10) ใช้เป็นแก๊สเชื้อเพลิงหุงต้ม แก๊สทั้งสองได้จากการกลั่นปิโตรเลียมและแก๊สธรรมชาติ เมื่อบรรจุในถังเหล็กภายใต้ความดันสูง จะมีสถานะเป็นของเหลว จึงเรียกว่า “แก๊สปิโตรเลียมเหลว” (Liquefied Petroleum Gas หรือ LPG)
4. เฮกเซน ใช้เป็นตัวทำละลายในอุตสาหกรรมการสกัดน้ำมันพืช และน้ำหอม
5. ไซโคลเฮกเซน ใช้เป็นตัวทำละลายในการทำเรซินและแลกเกอร์ ใช้ล้างสี ใช้เป็นสารตั้งต้นในการผลิตสารประกอบอินทรีย์ เช่น เบนซีน
6. แอลเคนที่มีมวลโมเลกุลสูง ๆ เช่น พาราฟิน ใช้เคลือบผักและผลไม้เพื่อรักษาความชุ่มชื้นและยับยั้งการเจริญเติบโตของเชื้อรา นอกจากนี้ ยังใช้แอลเคนเป็นสารตั้งต้นในอุตสาหกรรมหลายชนิด เช่น อึตสาหกรรมผลิตผงซักฟอก เส้นใย สารเคมีทางการเกษตร และสารกำจัดศัตรูพืช

 http://kame58.blogspot.com/2015/12/blog-post_27.html http://kame58.blogspot.com/2015/12/blog-post_27.html
 |


