
|
แรงแวนเดอร์วาลส์ มี 3 ชนิด คือ
|
![]() แรงไดโพลมีบทบาทสำคัญในการจัดเรียงตัวที่เป็นระเบียบของโมเลกุลในผลึก สำหรับโมเลกุลในสถานะแก๊สและของเหลว โมเลกุลมีการจัดเรียงตัวอย่างไม่เป็นระเบียบ เพราะมีการเคลื่อนไหวมากจึงเป็นผลให้แรงไดโพลมีทั้งแบบผลักและดึงดูด ซึ่งทำให้แรงลัพธ์ออกมา เป็นแรงดึงดูดอย่างอ่อนๆ
แรงไดโพลมีบทบาทสำคัญในการจัดเรียงตัวที่เป็นระเบียบของโมเลกุลในผลึก สำหรับโมเลกุลในสถานะแก๊สและของเหลว โมเลกุลมีการจัดเรียงตัวอย่างไม่เป็นระเบียบ เพราะมีการเคลื่อนไหวมากจึงเป็นผลให้แรงไดโพลมีทั้งแบบผลักและดึงดูด ซึ่งทำให้แรงลัพธ์ออกมา เป็นแรงดึงดูดอย่างอ่อนๆ
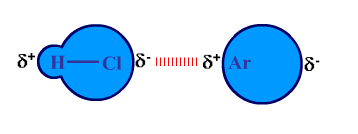
![]() 2. แรง dipole-induced dipole คือ แรงที่เกิดจากโมเลกุลที่มีขั้วเหนี่ยวนำให้โมเลกุล หรืออะตอมตัวอื่นมีขั้วด้วย จากนั้นอะตอมหรือโมเลกุลดังกล่าวก็มีแรงกระทำต่อกันเกิดขึ้น ซึ่งแรงนี้จะมากหรือน้อยขึ้นอยู่กับความสามารถในการเกิดมีขั้ว (polarizability) ของโมเลกุลที่ถูกเหนี่ยวนำ โดยทั่วไปอะตอมหรือโมเลกุลที่มีขนาดใหญ่ จะมีความสามารถในการเกิดมีขั้วสูงกว่า อะตอมหรือโมเลกุลที่มีขนาดเล็ก
2. แรง dipole-induced dipole คือ แรงที่เกิดจากโมเลกุลที่มีขั้วเหนี่ยวนำให้โมเลกุล หรืออะตอมตัวอื่นมีขั้วด้วย จากนั้นอะตอมหรือโมเลกุลดังกล่าวก็มีแรงกระทำต่อกันเกิดขึ้น ซึ่งแรงนี้จะมากหรือน้อยขึ้นอยู่กับความสามารถในการเกิดมีขั้ว (polarizability) ของโมเลกุลที่ถูกเหนี่ยวนำ โดยทั่วไปอะตอมหรือโมเลกุลที่มีขนาดใหญ่ จะมีความสามารถในการเกิดมีขั้วสูงกว่า อะตอมหรือโมเลกุลที่มีขนาดเล็ก
การเกิด แรง dipole-induced dipole เช่น HCl กับ Ar แสดงได้ดังรูป
![]() 3. แรง London (dispersion) คือ แรงดึงดูดระหว่างโมเลกุลที่ไม่มีขั้วด้วยกัน เช่น O2, Ne2 เป็นต้น เนื่องจากอิเล็กตรอนเคลื่อนที่แบบไร้ทิศทางทำให้บางครั้งอิเล็กตรอนมากระจุกกันอยู่บริเวณเดียวกันทำให้เกิดประจุลบบางส่วน(ประจุลบชั่วคราวที่มีค่าประจุน้อยมาก)เกิดขึ้น และทำให้บริเวณที่ไม่มีอิเล็กตรอนอยู่เกิดประจุบวกบางส่วน(ประจุบวกชั่วคราวที่มีค่าประจุน้อยมาก) ซึ่งแสดงได้ดังรูป
3. แรง London (dispersion) คือ แรงดึงดูดระหว่างโมเลกุลที่ไม่มีขั้วด้วยกัน เช่น O2, Ne2 เป็นต้น เนื่องจากอิเล็กตรอนเคลื่อนที่แบบไร้ทิศทางทำให้บางครั้งอิเล็กตรอนมากระจุกกันอยู่บริเวณเดียวกันทำให้เกิดประจุลบบางส่วน(ประจุลบชั่วคราวที่มีค่าประจุน้อยมาก)เกิดขึ้น และทำให้บริเวณที่ไม่มีอิเล็กตรอนอยู่เกิดประจุบวกบางส่วน(ประจุบวกชั่วคราวที่มีค่าประจุน้อยมาก) ซึ่งแสดงได้ดังรูป
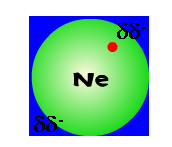
หลังจากอะตอมจะกลายเป็นอะตอมที่มีขั้วชั่วคราว อะตอมที่มีขั้วก็จะเหนี่ยวนำให้อะตอมใกล้เคียงกลายเป็นอะตอมที่มีขั้วตามไปด้วย ซึ่งแสดงได้ดังรูป
 \
\
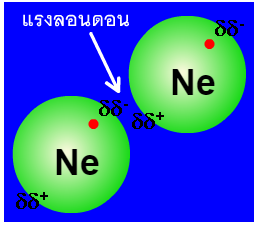
จากรูปแสดงการเกิดแรงลอนดอนของ Ne โดยจุดสีแดงคือ electron จะเห็นว่าบางครั้งอิเล็กตรอนอยู่ ณ.บริเวณใดบริเวณหนึ่งของอะตอมมากกว่าบริเวณหนึ่ง กลายเป็นอะตอมที่มีขั้วบางส่วน จากนั้นก็จะเหนี่ยวนำให้อะตอม Ne ใกล้เคียงกลายเป็นอะตอมที่มีขั้วบางส่วนตามไปด้วย จึงเกิดแรงดึงดูดซึ่งกันและกันแต่ว่าเป็นแรงดึงดูดแบบอ่อน

![]() http://www.il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/vanderwaals.htm
http://www.il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/vanderwaals.htm
