|
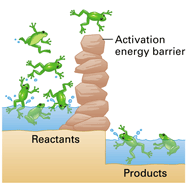
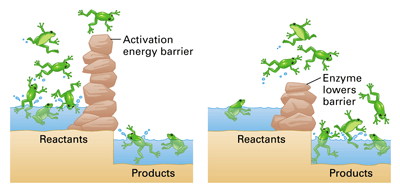
พลังงานก่อกัมมันต์ (พลังงานกระตุ้น = Activation energy) ย่อว่า Ea คือ พลังงานจำนวนน้อยที่สุดที่เกิดจากการชนของอนุภาคของสารตั้งต้น แล้วทำให้เกิดปฏิกิริยาเคมี ใช้หน่วยเป็น kJ/mol หรือ kcal/mol ลักษณะสำคัญของพลังงานก่อกัมมันต์
http://kruwee.files.wordpress.com/2011/01/ ในการพิจารณาการเกิดปฏิกิริยาจะ เกิดขึน้ มากหรือน้อยขึน้ อยู่กับจำนวนอนุภาค ที่มีพลังงานสูงพอและค่าพลังงานก่อกัมมันต์ กล่าวคือ เมื่อจำ นวนอนุภาคที่มีพลังงานสูง กว่าพลังงานก่อกัมมันต์มีมาก(จำนวนกบที่ มีพลังงานมาก)โอกาสในการเกิดปฏิกิริยาก็จะ มีมากขึน้ ด้วย(ข้ามกำแพงได้มาก) และเมื่อพลังงานก่อกัมมันต์ต่า (กาแพงเตยี้ๆ) ก็จะทำให้มีจำนวนอนุภาคที่มีพลังงานสูงกว่าพลังงานก่อกัมมันต์มีจำนวนเพิ่มขึ้น จึงมีโอกาสเกิดปฏิกิริยาได้มากขึ้นด้วย ดังนั้นการชนที่จะเกิดปฏิกิริยาได้นั้น ต้องเป็นการชนที่มีทิศทางเหมาะสมและมีพลังงานมากพอ (อย่างน้อยเท่ากับพลังงานก่อกัมมันต์)
http://kruwee.files.wordpress.com/2011/01/
http://kruwee.files.wordpress.com/2011/01/ |