
 เมื่อสารทำปฏิกิริยากัน ที่ภาวะสมดุลจะมีทั้งสารที่เข้าทำปฏิกิริยา (reactant) และผลผลิต (product) ภาวะสมดุล (equilibrium state) เกิดขึ้นเมื่ออัตราการเกิดปฏิกิริยาไปข้างหน้า (forward reaction ) เท่ากับอัตราการเกิดปฏิกิริยาย้อนกลับ (reverse reaction ) ถ้าในระบบที่พิจารณาถ้าปฏิกิริยาเปลี่ยนไปข้างหน้าและย้อนกลับเกิดขึ้นตลอดเวลา เรียกว่า สมดุลพลวัต หรือสมดุลไดนามิก (dynamic equilibrium) เขียนแทนด้วยลูกศรไป-กลับ เมื่อสารทำปฏิกิริยากัน ที่ภาวะสมดุลจะมีทั้งสารที่เข้าทำปฏิกิริยา (reactant) และผลผลิต (product) ภาวะสมดุล (equilibrium state) เกิดขึ้นเมื่ออัตราการเกิดปฏิกิริยาไปข้างหน้า (forward reaction ) เท่ากับอัตราการเกิดปฏิกิริยาย้อนกลับ (reverse reaction ) ถ้าในระบบที่พิจารณาถ้าปฏิกิริยาเปลี่ยนไปข้างหน้าและย้อนกลับเกิดขึ้นตลอดเวลา เรียกว่า สมดุลพลวัต หรือสมดุลไดนามิก (dynamic equilibrium) เขียนแทนด้วยลูกศรไป-กลับ
1. ภาวะสมดุลระหว่างสถานะ
 สารต่างๆสามารถเปลี่ยนสถานะได้ โดยมีการเปลี่ยนแปลงพลังงานควบคู่ไปด้วย สารต่างๆสามารถเปลี่ยนสถานะได้ โดยมีการเปลี่ยนแปลงพลังงานควบคู่ไปด้วย
 เราสามารถสังเกตจากสีที่คงที่ หรือ สถานะของสารคงที่ดูเสมือนไม่เกิดการเปลี่ยนแปลง แต่ความจริงแล้วระบบมิได้หยุดนิ่งและมีการเปลี่ยนแปลงตลอดเวลาเรียกการเกิดสภาวะแบบนี้ว่า “สมดุลไดนามิก” ดังนั้นภาวะสมดุลระหว่างสถานะ ก็เป็นสมดุลไดนามิก เราสามารถสังเกตจากสีที่คงที่ หรือ สถานะของสารคงที่ดูเสมือนไม่เกิดการเปลี่ยนแปลง แต่ความจริงแล้วระบบมิได้หยุดนิ่งและมีการเปลี่ยนแปลงตลอดเวลาเรียกการเกิดสภาวะแบบนี้ว่า “สมดุลไดนามิก” ดังนั้นภาวะสมดุลระหว่างสถานะ ก็เป็นสมดุลไดนามิก
2. ภาวะสมดุลในสารละลายอิ่มตัว
 เมื่อให้ตัวถูกละลาย ละลายในตัวทาละลาย ตัวถูกละลายก็จะละลายได้เร็วในตอนแรกแล้วละลายได้ช้าลงและเมื่อเกิดสารละลายอิ่ม ตัว เราจะพบว่าตัวถูกละลายไม่ละลายต่อไปอีกไม่ เมื่อให้ตัวถูกละลาย ละลายในตัวทาละลาย ตัวถูกละลายก็จะละลายได้เร็วในตอนแรกแล้วละลายได้ช้าลงและเมื่อเกิดสารละลายอิ่ม ตัว เราจะพบว่าตัวถูกละลายไม่ละลายต่อไปอีกไม่
 ว่าจะคนสารละลายเป็นเวลานานเท่าใดถ้าอุณหภูมิคงที่ เช่น การนาเกลือแกง (NaCl) มาละลายน้า จนได้สารละลาย และละลายต่อจนได้สารละลายอมิ่ ตัว เมื่อตั้งสารละลายอมิ่ ตัวไว้จะเกิดผลึกของ NaCl เกิดขึ้น แล้วจะมีปริมาณเพมิ่ ขึ้นเรื่อยๆจนในที่สุดผลึกคงที่ เรายังดูเหมือนว่าไม่เกิดผลึกอีก แต่ในระบบผลึกยังคงเกิดขึ้นเรื่อยๆ แล้วก็ละลายในสารละลายอีกด้วย ดังนั้น ภาวะสมดุลในสารละลายอมิ่ ตัวก็เป็นสมดุลไดนามิก ว่าจะคนสารละลายเป็นเวลานานเท่าใดถ้าอุณหภูมิคงที่ เช่น การนาเกลือแกง (NaCl) มาละลายน้า จนได้สารละลาย และละลายต่อจนได้สารละลายอมิ่ ตัว เมื่อตั้งสารละลายอมิ่ ตัวไว้จะเกิดผลึกของ NaCl เกิดขึ้น แล้วจะมีปริมาณเพมิ่ ขึ้นเรื่อยๆจนในที่สุดผลึกคงที่ เรายังดูเหมือนว่าไม่เกิดผลึกอีก แต่ในระบบผลึกยังคงเกิดขึ้นเรื่อยๆ แล้วก็ละลายในสารละลายอีกด้วย ดังนั้น ภาวะสมดุลในสารละลายอมิ่ ตัวก็เป็นสมดุลไดนามิก
3. ภาวะสมดุลในปฏิกิริยาเคมี
 ภาวะสมดุลในปฏิกิริยาเคมีเกิดขึ้นได้ก็ต่อเมื่อเป็นปฏิกิริยาผันกลับได้และเกิดปฏิกิริยาในระบบปิด โดยระบบ แบ่งออกเป็น ภาวะสมดุลในปฏิกิริยาเคมีเกิดขึ้นได้ก็ต่อเมื่อเป็นปฏิกิริยาผันกลับได้และเกิดปฏิกิริยาในระบบปิด โดยระบบ แบ่งออกเป็น
 1) ระบบเปิด (Opened system) คือระบบที่มีการถ่ายเทได้ทัง้ มวลสารและพลังงานกับสิ่ง แวดล้อม 1) ระบบเปิด (Opened system) คือระบบที่มีการถ่ายเทได้ทัง้ มวลสารและพลังงานกับสิ่ง แวดล้อม
 2) ระบบปิด (Closed system) คือระบบที่มีการถ่ายเทเฉพาะพลังงานอย่างเดียว แต่ไม่มีการถ่ายเทมวลสาร 2) ระบบปิด (Closed system) คือระบบที่มีการถ่ายเทเฉพาะพลังงานอย่างเดียว แต่ไม่มีการถ่ายเทมวลสาร
 3) ระบบโดดเดี่ยว (Isolated system) คือระบบที่ไม่มีการถ่ายเททัง้ พลังงานและมวลสารแก่สิ่งแวดล้อม 3) ระบบโดดเดี่ยว (Isolated system) คือระบบที่ไม่มีการถ่ายเททัง้ พลังงานและมวลสารแก่สิ่งแวดล้อม
| |
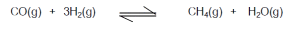 |
 ถ้าเริ่ม ต้นเราใส่ CO จา นวน 1.0 โมล และ H2 จา นวน 3.0 โมล ลงในภาชนะขนาด 10.0ลิตร ที่ 1200 K อัตราการเกิดปฏิกิริยาระหว่าง CO กับ H2 ขึ้นกับความเข้มข้นของ CO และ H2คือ ตอนแรกๆ สารทั้งสองชนิดมีความเข้มข้นมาก แต่เมื่อสารทำปฏิกิริยากัน ความเข้มข้นจะลดลงเรื่อยๆ นั่น คือ อัตราการเกิดปฏิกิริยาจะสูงในช่วงแรกๆ แล้วจะค่อยๆลดลง ในขณะที่ความเข้มข้นของผลผลิต (ที่มีค่าเท่ากับศูนย์ในตอนแรก) จะค่อยๆเพิ่ม ขึ้น และมีค่าคงที่เมื่อถึงภาวะสมดุล หรือกล่าวได้อีกอย่างหนึ่งว่า ตอนแรกๆอัตราการเกิดปฏิกิริยาย้อนกลับมีค่าเป็นศูนย์แล้วค่อยๆ เพิ่ม ขึ้นจนเท่ากับอัตราการเกิดปฏิกิริยาไปข้างหน้า เมื่อถึงสมดุล ที่ภาวะสมดุล ความเข้มข้นของสารต่างๆ มีค่าคงที่ และเราจะไม่เห็นการเปลี่ยนแปลงใดๆ อีกถึงแม้ว่าปฏิกิริยายังคงดาเนินไป ถ้าเริ่ม ต้นเราใส่ CO จา นวน 1.0 โมล และ H2 จา นวน 3.0 โมล ลงในภาชนะขนาด 10.0ลิตร ที่ 1200 K อัตราการเกิดปฏิกิริยาระหว่าง CO กับ H2 ขึ้นกับความเข้มข้นของ CO และ H2คือ ตอนแรกๆ สารทั้งสองชนิดมีความเข้มข้นมาก แต่เมื่อสารทำปฏิกิริยากัน ความเข้มข้นจะลดลงเรื่อยๆ นั่น คือ อัตราการเกิดปฏิกิริยาจะสูงในช่วงแรกๆ แล้วจะค่อยๆลดลง ในขณะที่ความเข้มข้นของผลผลิต (ที่มีค่าเท่ากับศูนย์ในตอนแรก) จะค่อยๆเพิ่ม ขึ้น และมีค่าคงที่เมื่อถึงภาวะสมดุล หรือกล่าวได้อีกอย่างหนึ่งว่า ตอนแรกๆอัตราการเกิดปฏิกิริยาย้อนกลับมีค่าเป็นศูนย์แล้วค่อยๆ เพิ่ม ขึ้นจนเท่ากับอัตราการเกิดปฏิกิริยาไปข้างหน้า เมื่อถึงสมดุล ที่ภาวะสมดุล ความเข้มข้นของสารต่างๆ มีค่าคงที่ และเราจะไม่เห็นการเปลี่ยนแปลงใดๆ อีกถึงแม้ว่าปฏิกิริยายังคงดาเนินไป
ดังนั้น ในปฏิกิริยาใดจะเกิดสมดุลได้จะต้อง
 1. เกิดในระบบปิด 1. เกิดในระบบปิด
 2. มีสมดุลไดนามิก 2. มีสมดุลไดนามิก
 3. ยังมีสารตั้ง ต้นเหลืออยู่ 3. ยังมีสารตั้ง ต้นเหลืออยู่
 4. ระบบสามารถเข้าสู่สมดุลได้ไม่ว่าจะเรมิ่ ต้นจากไปข้างหน้าหรือย้อนกลับ 4. ระบบสามารถเข้าสู่สมดุลได้ไม่ว่าจะเรมิ่ ต้นจากไปข้างหน้าหรือย้อนกลับ
 5. เกิดการเปลี่ยนแปลงที่ผันกลับได้ 5. เกิดการเปลี่ยนแปลงที่ผันกลับได้
 6. ความเข้มข้น, ความดัน และ อุณหภูมิมีผลต่อภาวะสมดุล 6. ความเข้มข้น, ความดัน และ อุณหภูมิมีผลต่อภาวะสมดุล

 https://enchemcom2c.wordpress.com/2012/09/12/สมดุลเคมี-chemical-equilibrium-2/ https://enchemcom2c.wordpress.com/2012/09/12/สมดุลเคมี-chemical-equilibrium-2/
 |

